??? 為全面反映2020年我國藥品不良反應監(jiān)測情況,提高安全用藥水平��,更好地保障公眾用藥安全,國家藥品不良反應監(jiān)測中心組織編撰《國家藥品不良反應監(jiān)測年度報告(2020年)》�����。
第1章 藥品不良反應監(jiān)測工作情況
2020年�,面對突如其來的新冠肺炎疫情���,全國各級藥品不良反應監(jiān)測機構上下同心����,全力以赴,按照習近平總書記對食品藥品“四個最嚴”要求����,藥品不良反應監(jiān)測評價工作平穩(wěn)有序開展,法規(guī)制度不斷完善�,監(jiān)測評價體系逐步健全,報告數量和質量穩(wěn)步提升��,風險控制手段更加成熟��,各項工作取得明顯成效����,為藥品監(jiān)管提供了科學有力支撐。
一是強化頂層設計�����,規(guī)劃體系能力建設目標��。發(fā)布《關于進一步加強藥品不良反應監(jiān)測評價體系和能力建設的意見》��,明確“十四五”期間監(jiān)測評價體系和能力建設的六項目標、九項任務和三項保障�,加快完善監(jiān)測評價制度體系,不斷提高監(jiān)測評價能力�����。
二是落實法規(guī)要求�,推動配套技術規(guī)范出臺。發(fā)布《藥物警戒委托協(xié)議撰寫指導原則(試行)》�,起草《藥物警戒質量管理規(guī)范》,指導藥品上市許可持有人(以下簡稱持有人)開展監(jiān)測��、報告�、分析和評價工作,推動藥物警戒制度建立健全���。
三是科學分析評價���,充分發(fā)揮技術支撐作用。密切關注國內外監(jiān)管動態(tài)����,強化監(jiān)測數據分析評價。根據評價結果��,及時發(fā)布藥品安全警示信息����。2020年發(fā)布注銷安乃近注射液等品種藥品注冊證書公告共3期,發(fā)布藥品說明書修訂公告共47期���。
四是有效監(jiān)測風險��,保障疫情防控用藥安全��。面對疫情���,全國各級監(jiān)測機構迅速響應,密切跟進《新型冠狀病毒肺炎診療方案》所列藥品�����,重點關注相關預警信號���、群體事件及藥品不良反應報告情況�����,全面加強新冠肺炎防控及治療藥品監(jiān)測���、分析和評價����,切實保障疫情防控用藥安全�����。
五是升級信息系統(tǒng)�,助力監(jiān)測評價工作發(fā)展。加快轉化實施ICH E2B(R3)數據標準����,建成兼容在線報告、網關傳輸���、XML文件遞交多種報告途徑的藥品上市許可持有人直報系統(tǒng)��。繼續(xù)加強與醫(yī)療機構的合作�����,迄今為止�,已在全國366家三級醫(yī)療機構建立藥品不良反應監(jiān)測哨點。
第2章 藥品不良反應/事件報告情況
2.1 報告總體情況
2.1.1 2020年度藥品不良反應/事件報告情況
2020年全國藥品不良反應監(jiān)測網絡收到《藥品不良反應/事件報告表》167.6萬份�。1999年至2020年,全國藥品不良反應監(jiān)測網絡累計收到《藥品不良反應/事件報告表》1,687萬份(圖1)�����。
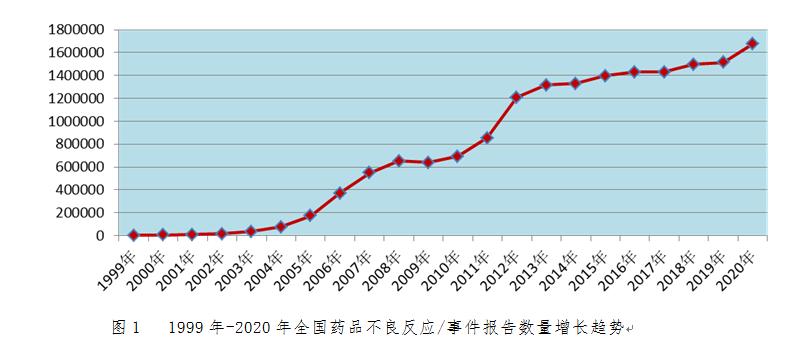
2.1.2 新的和嚴重藥品不良反應/事件報告情況
2020年全國藥品不良反應監(jiān)測網絡收到新的和嚴重藥品不良反應/事件報告50.6萬份����;新的和嚴重藥品不良反應/事件報告占同期報告總數的30.2%����。
2020年全國藥品不良反應監(jiān)測網絡收到嚴重藥品不良反應/事件報告16.7萬份,嚴重藥品不良反應/事件報告占同期報告總數的10.0%(圖2)�。

小貼士:
如何認識藥品不良反應報告?
藥品不良反應是指合格藥品在正常用法用量下出現的與用藥目的無關的有害反應�。藥品不良反應是藥品的固有屬性,一般來說�,所有藥品都會存在或多或少、或輕或重的不良反應�。
藥品不良反應監(jiān)測是藥品上市后安全監(jiān)管的重要支撐,其目的是及時發(fā)現和控制藥品安全風險��。持有人��、經營企業(yè)���、醫(yī)療機構應當報告所發(fā)現的藥品不良反應�,國家鼓勵公民、法人和其他組織報告藥品不良反應�。
經過各方努力,持有人����、經營企業(yè)、醫(yī)療機構報告藥品不良反應的積極性已經逐步提高���,我國藥品不良反應報告數量總體呈上升趨勢��。嚴重藥品不良反應/事件報告比例是衡量報告總體質量和可利用性的重要指標之一�,藥品不良反應監(jiān)測評價工作一直將收集和評價新的和嚴重反應作為重點內容����。新的和嚴重藥品不良反應報告,尤其是嚴重藥品不良反應報告數量多了���,并非說明藥品安全水平下降��,而意味著監(jiān)管部門掌握的信息越來越全面����,對藥品的風險更了解,風險更可控���,對藥品的評價更加有依據���,監(jiān)管決策更加準確。同樣�����,在醫(yī)療實踐中��,能及時了解藥品不良反應發(fā)生的表現��、程度����,并最大限度地加以避免���,也是保證患者用藥安全的重要措施���。
2.1.3 每百萬人口平均報告情況
每百萬人口平均報告數量是衡量一個國家藥品不良反應監(jiān)測工作水平的重要指標之一。2020年我國每百萬人口平均報告數為1,251份�����。
2.1.4 藥品不良反應/事件縣級報告比例
藥品不良反應/事件縣級報告比例是衡量我國藥品不良反應監(jiān)測工作均衡發(fā)展及覆蓋程度的重要指標之一�。2020年全國98.3%的縣級地區(qū)報告了藥品不良反應/事件。
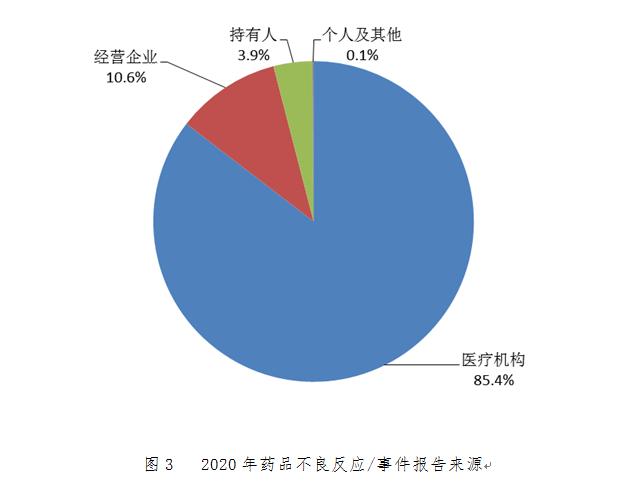
2.1.5 藥品不良反應/事件報告來源
持有人����、經營企業(yè)和醫(yī)療機構是藥品不良反應報告的責任單位。按照報告來源統(tǒng)計���,2020年來自醫(yī)療機構的報告占85.4%�����;來自經營企業(yè)的報告占10.6%���;來自持有人的報告占3.9%;來自個人及其他報告者的報告占0.1%(圖3)��。
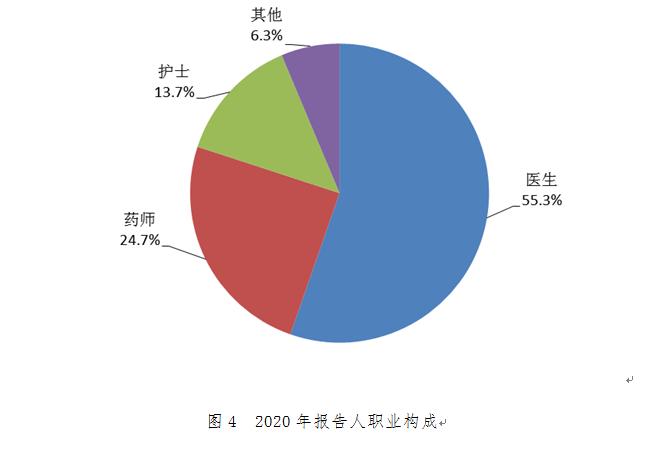
2.1.6 報告人職業(yè)
按照報告人職業(yè)統(tǒng)計���,醫(yī)生占55.3%�,藥師占24.7%,護士占13.7%�,其他職業(yè)占6.3%(圖4)。
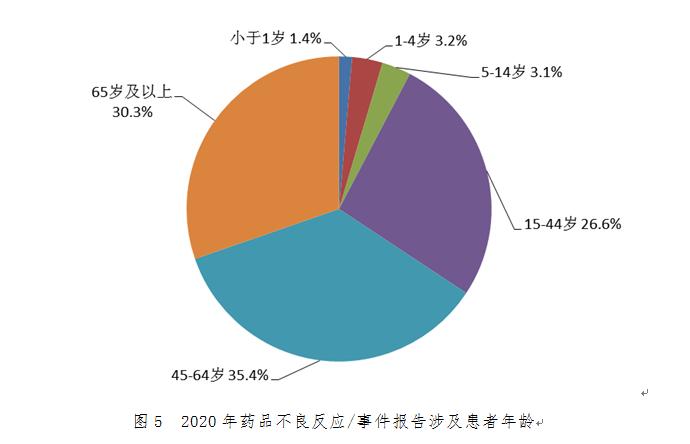
2.1.7 藥品不良反應/事件報告涉及患者情況
2020年藥品不良反應/事件報告中�,男女性別比為0.87:1,女性略多于男性��。從年齡分布看���,14歲以下兒童占7.7%�,65歲及以上老年患者占30.3%(圖5)����。
2.1.8 藥品不良反應/事件報告涉及藥品情況
按照懷疑藥品類別統(tǒng)計���,化學藥品占83.0%�����、中藥占13.4%��、生物制品占1.1%�、無法分類者占2.5%(圖6)�����。
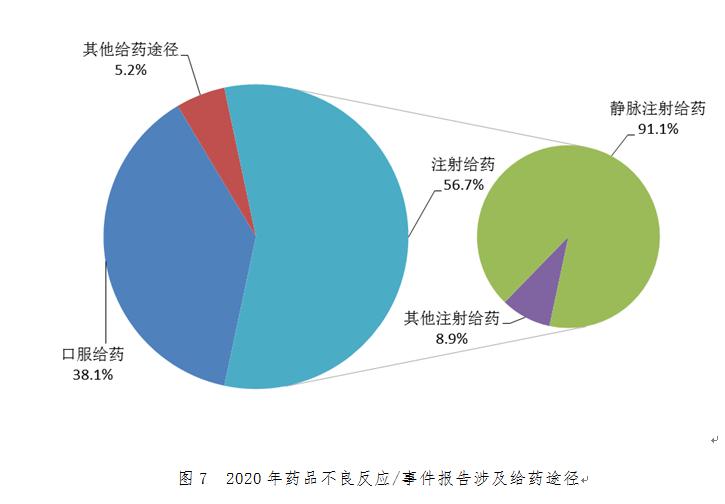
按照給藥途徑統(tǒng)計,2020年藥品不良反應/事件報告中��,注射給藥占56.7%�、口服給藥占38.1%、其他給藥途徑占5.2%�。注射給藥中,靜脈注射給藥占91.1%�����、其他注射給藥占8.9%(圖7)�����。
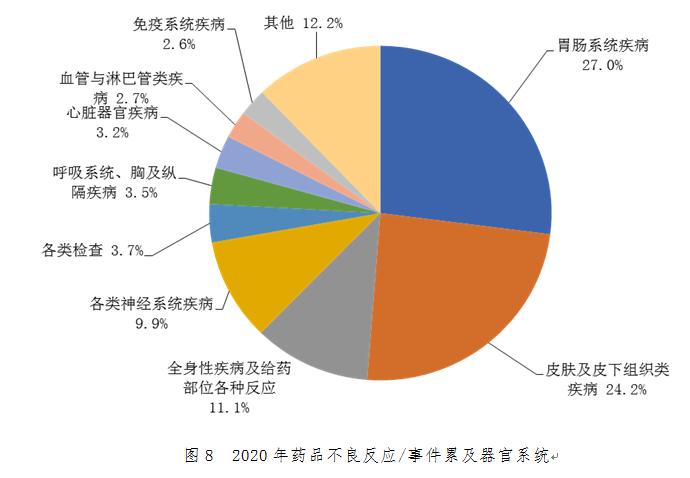
2.1.9 藥品不良反應/事件累及器官系統(tǒng)情況
2020年報告的藥品不良反應/事件中����,累及器官系統(tǒng)排名前3位依次為胃腸系統(tǒng)疾病、皮膚及皮下組織類疾病�����、全身性疾病及給藥部位各種反應���。
2.2 基本藥物監(jiān)測情況
2.2.1 國家基本藥物監(jiān)測總體情況
2020年全國藥品不良反應監(jiān)測網絡共收到《國家基本藥物目錄(2018年版)》收載品種的不良反應/事件報告83.0萬份���,其中嚴重報告8.8萬份���,占10.6%。報告涉及化學藥品和生物制品占88.1%��,中成藥占11.9%���。
2.2.2 國家基本藥物化學藥品和生物制品情況分析
《國家基本藥物目錄(2018年版)》化學藥品和生物制品部分共417個(類)品種�。2020年全國藥品不良反應監(jiān)測網絡共收到國家基本藥物化學藥品和生物制品藥品不良反應/事件報告78.1萬例次�,其中嚴重報告10.4萬例次,占13.4%���。
2020年國家基本藥物化學藥品和生物制品不良反應/事件報告按照藥品類別統(tǒng)計,報告數量排名前5位的分別是抗微生物藥����、心血管系統(tǒng)用藥、抗腫瘤藥����、激素及影響內分泌藥����、治療精神障礙藥����;累及器官系統(tǒng)排名前5位的是胃腸系統(tǒng)疾病、皮膚及皮下組織類疾病�、全身性疾病及給藥部位各種反應、各類神經系統(tǒng)疾病以及各類檢查���。
2.2.3 國家基本藥物中成藥情況分析
《國家基本藥物目錄(2018年版)》中成藥共涉及268個品種����。2020年全國藥品不良反應監(jiān)測網絡收到國家基本藥物中成藥不良反應/事件報告10.5萬例次����,其中嚴重報告6,358例次,占6.0%�。2020年國家基本藥物7大類中成藥中,藥品不良反應/事件報告總數由多到少依次為內科用藥��、骨傷科用藥���、婦科用藥�、外科用藥、耳鼻喉科用藥�、兒科用藥、眼科用藥�。
以上監(jiān)測數據表明,2020年國家基本藥物監(jiān)測總體情況基本保持平穩(wěn)�。
小貼士:
《國家基本藥物目錄(2018年版)》收錄品種情況
2018年11月1日起,我國正式啟用《國家基本藥物目錄(2018年版)》�����。該目錄主要分為化學藥品和生物制品���、中成藥和中藥飲片三個部分����。其中化學藥品和生物制品部分包括抗微生物藥�����、抗寄生蟲病藥��、麻醉藥等26類藥品�����,中成藥部分包括內科用藥����、外科用藥、婦科用藥等7類藥品���。與2012年版基藥目錄相比���,2018年版基藥目錄共調入藥品187種,調出22種(其中17個為化藥)����,目錄總品種數量由原來的520種增加到685種,其中西藥417種���、中成藥268種���。
2.3 化學藥品、生物制品監(jiān)測情況
? 2.3.1 總體情況
2020年藥品不良反應/事件報告中��,涉及懷疑藥品179.8萬例次�����,其中化學藥品占83.0%,生物制品占1.1%�。2020年嚴重不良反應/事件報告涉及懷疑藥品21.3萬例次,其中化學藥品占90.3%����,生物制品占1.2%。
? 2.3.2 涉及患者情況
2020年化學藥品�、生物制品不良反應/事件報告中,男女患者比為0.86:1����,女性多于男性。14歲以下兒童患者的報告占7.7%��,65歲及以上老年患者的報告占30.9%���。
? 2.3.3 涉及藥品情況
2020年藥品不良反應/事件報告涉及的化學藥品中��,例次數排名前5位的類別依次為抗感染藥�����、心血管系統(tǒng)用藥�、腫瘤用藥、電解質/酸堿平衡及營養(yǎng)藥�����、神經系統(tǒng)用藥���。2020年嚴重藥品不良反應/事件涉及化學藥品中,報告數量最多的為腫瘤用藥�����,占32.2%�;其次是抗感染藥,占28.3%����。按嚴重報告占本類別報告比例計算,腫瘤用藥的嚴重報告比例最高���,為41.5%�,其次是免疫系統(tǒng)用藥���,為21.4%�����。
2020年藥品不良反應/事件報告涉及的生物制品中�,抗毒素及免疫血清占37.8%,細胞因子占27.7%����,血液制品占4.9%。
按劑型統(tǒng)計�,2020年化學藥品不良反應/事件報告中,注射劑�、口服制劑所占比例分別為60.4%和35.0%,其他劑型占4.6%�����。生物制品中��,注射劑�����、口服制劑占比分別為94.4%和0.3%��,其他制劑占5.3%�����。
? 2.3.4 總體情況分析
2020年化學藥品和生物制品不良反應/事件報告情況與2019年基本一致。從不良反應涉及患者年齡看�,14歲以下兒童占比較2019年明顯降低,提示兒童用藥的安全性總體良好�����;65歲及以上老年患者占比持續(xù)升高���,提示臨床應加大對老年患者安全用藥的管理。從藥品類別上看�,抗感染藥報告數量依然居于首位,但占比已連續(xù)9年呈下降趨勢��,反映出臨床抗感染藥的使用日趨合理�;腫瘤用藥占比依然呈上升趨勢,其嚴重報告構成比居于首位�,提示腫瘤用藥的安全性風險需持續(xù)關注。從藥品劑型上看�,化學藥品和生物制品報告中注射劑占比均出現較明顯下降,與總體報告中注射劑不良反應的下降趨勢基本一致�����。
小貼士:
什么是藥物相互作用?
藥物與藥物之間的相互作用���,是指兩種或兩種以上藥物同時或先后序貫應用時�����,藥物之間的相互影響和干擾可改變藥物的體內過程及機體對藥物的反應性���,從而使藥物的藥理效應或毒性發(fā)生變化。藥物的相互作用包括兩個方面:一是不影響藥物在體液中的濃度但改變藥理作用��,使原有的效應增強或減弱���;二是通過藥物的吸收���、分布、代謝和排泄��,改變藥物在作用部位的濃度而影響藥物作用��。引起藥物相互作用的因素較多����,一些弱酸性或弱堿性藥物可能改變體內pH值����,從而影響其他藥物的解離度���,如抗酸藥奧美拉唑可以與酮康唑等藥物發(fā)生相互作用����;一些藥物可以抑制肝臟藥物代謝酶���,減慢其他藥物的代謝,如西咪替丁可以與華法林等藥物發(fā)生相互作用����;一些藥物可能與其他藥物競爭結合受體,導致其他藥物的治療作用增強或減弱�����,如普萘洛爾可以與異丙腎上腺素等藥物發(fā)生相互作用�。藥物相互作用情況,可以參見藥品說明書中【藥物相互作用】項下的內容�。患者應養(yǎng)成記錄自己使用藥物的習慣����,看醫(yī)生或去藥店購買藥品時����,準確告訴醫(yī)生和藥師目前正在使用的藥物����;用藥前詳細閱讀藥品說明書,如果有疑問應及時咨詢醫(yī)生或藥師�����。
2.4 中藥監(jiān)測情況
? 2.4.1 總體情況
2020年藥品不良反應/事件報告中���,涉及懷疑藥品179.8萬例次����,其中中藥占13.4%��;2020年嚴重不良反應/事件報告涉及懷疑藥品21.3萬例次��,其中中藥占6.3%�����。
2.4.2 涉及患者情況
2020年中藥不良反應/事件報告中,男女患者比為0.82:1����。14歲以下兒童患者占6.0%,65歲及以上老年患者占28.1%���。
? 2.4.3 涉及藥品情況
2020年藥品不良反應/事件報告涉及的中藥中�,例次數排名前5位的類別分別是理血劑中活血化瘀藥(25.8%)����、清熱劑中清熱解毒藥(11.9%)、祛濕劑中清熱除濕藥(6.5%)����、補益劑中益氣養(yǎng)陰藥(5.7%)���、祛濕劑中祛風勝濕藥(4.6%)�����。2020年中藥嚴重不良反應/事件報告的例次數排名前5位的類別分別是理血劑中活血化瘀藥(41.2%)��、補益劑中益氣養(yǎng)陰藥(12.7%)��、開竅劑中涼開藥(7.9%)�����、清熱劑中清熱解毒藥(7.3%)�、祛濕劑中清熱除濕藥(3.0%)。
2020年中藥不良反應/事件報告按照給藥途徑統(tǒng)計����,注射給藥占33.3%、口服給藥占56.4%��、其他給藥途徑占10.3%����。注射給藥中,靜脈注射給藥占97.8%�����、其他注射給藥占2.2%�。
? 2.4.4 總體情況分析
與2019年相比,2020年中藥不良反應/事件報告數量有所上升��,但嚴重報告占比有所下降。從給藥途徑看��,注射給藥占比下降較為明顯�����。從藥品類別上看��,活血化瘀藥的報告數量依然居首位�����,但占比略有下降�。從總體情況看,2020年中藥占總體不良反應/事件報告比例呈下降趨勢�,但仍需要注意安全用藥。
小貼士:
為什么中藥會引起不良反應�����?
中藥和其他藥品一樣��,也可能會產生不良反應����。辨證論治是中醫(yī)認識疾病和治療疾病的基本原則,中藥的使用講究合理組方���、一人一方����、隨證加減�,有時還存在講究道地藥材、如法炮制等�����。嚴格地說���,在這樣的情況下服用中藥���,有助減少和避免不良反應/事件。但是如果不遵守辯證論治的原則或者辯證不當�����,組方不合理�����,將引發(fā)更多不良反應/事件。現在許多中成藥�����、中藥新劑型在使用過程中��,不良反應也很多��,應該引起重視�����。
第3章 相關風險控制措施
根據2020年藥品不良反應監(jiān)測數據和分析評價結果���,國家藥品監(jiān)督管理局對發(fā)現存在安全隱患的藥品及時采取相應風險控制措施�,以保障公眾用藥安全����。
發(fā)布關于注銷安乃近注射液等品種、含磺胺二甲嘧啶制劑�、羥布宗片藥品注冊證書的公告共3期。
發(fā)布甲磺酸阿帕替尼片���、銀杏葉片、復方甘草片等藥品說明書修訂公告共47期,增加或完善57個(類)品種說明書中的警示語�����、不良反應����、注意事項、禁忌等安全性信息�����。
發(fā)布《藥物警戒快訊》12期����,報道國外藥品安全信息61條。
第4章 各論
根據藥品不良反應監(jiān)測結果以及公眾關注情況�����,對抗感染藥�、心血管系統(tǒng)用藥、診斷用藥����、注射劑��、老年人用藥的不良反應報告情況進行分析����,并提示安全風險如下:
4.1 關注抗感染藥用藥風險
抗感染藥是指具有殺滅或抑制各種病原微生物作用的藥品�����,包括抗生素�、合成抗菌藥、抗真菌藥����、抗病毒藥等,是臨床應用最為廣泛的藥品類別之一��,其不良反應/事件報告數量一直居于首位��,是藥品不良反應監(jiān)測工作關注的重點�。
2020年全國藥品不良反應監(jiān)測網絡共收到抗感染藥不良反應/事件報告49.5萬份,其中嚴重報告4.9萬份�����,占9.8%�����?����?垢腥舅幉涣挤磻?事件報告占2020年總體報告的29.5%����。
4.1.1 涉及藥品情況
2020年抗感染藥不良反應/事件報告數量排名前3位的藥品類別分別是頭孢菌素類、喹諾酮類����、青霉素類,嚴重不良反應/事件報告數量排名前3位的藥品類別分別是頭孢菌素類���、喹諾酮類�����、抗結核病藥��。
2020年抗感染藥不良反應/事件報告中�,注射劑占76.0%��,口服制劑占20.3%,其他劑型占3.7%�����;與藥品總體報告劑型分布相比�,注射劑比例偏高。嚴重不良反應/事件報告中���,注射劑占78.8%�����,口服制劑占20.2%���,其他劑型占1.0%。
4.1.2 累及器官系統(tǒng)情況
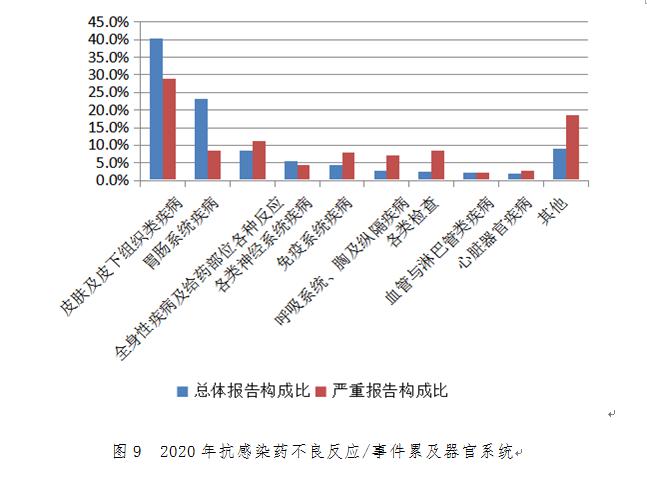
2020年抗感染藥不良反應/事件報告中���,整體報告和嚴重報告的藥品不良反應/事件累及器官系統(tǒng)情況詳見圖9���。與抗感染藥的整體報告相比,嚴重報告的全身性疾病及給藥部位各種反應�����、免疫系統(tǒng)疾病、呼吸系統(tǒng)��、胸及縱隔疾病�、各類檢查構成比明顯偏高。
抗感染藥整體藥品不良反應/事件報告中��,口服制劑累及器官系統(tǒng)排名前5位的是胃腸系統(tǒng)疾病���、皮膚及皮下組織類疾病、各類神經系統(tǒng)疾病�、肝膽系統(tǒng)疾病、全身性疾病及給藥部位各種反應��;注射劑累及器官系統(tǒng)排名前5位是皮膚及皮下組織類疾病�����、胃腸系統(tǒng)疾病����、全身性疾病及給藥部位各種反應、各類神經系統(tǒng)疾病���、免疫系統(tǒng)疾病����。
抗感染藥嚴重藥品不良反應/事件報告中,口服制劑累及器官系統(tǒng)排名前5位是皮膚及皮下組織類疾病�、肝膽系統(tǒng)疾病、各類檢查��、胃腸系統(tǒng)疾病����、代謝及營養(yǎng)類疾病�����;注射劑累及器官系統(tǒng)排名前5位是皮膚及皮下組織類疾病�、全身性疾病及給藥部位各種反應、免疫系統(tǒng)疾病��、呼吸系統(tǒng)�、胸及縱隔疾病、胃腸系統(tǒng)疾病�。
4.1.3 監(jiān)測情況分析及安全風險提示
近年來,抗感染藥不良反應/事件報告占總體報告比例呈現持續(xù)下降趨勢�,說明國家加強抗感染藥使用管理等措施取得一定實效,但其嚴重不良反應報告數量仍然很高,提示抗感染藥的用藥風險仍需繼續(xù)關注�����。
小貼士:
阿米卡星的嚴重不良反應主要有哪些�?
阿米卡星是一種氨基糖苷類抗生素,是2018年版國家基本藥物目錄品種�。和所有的氨基糖苷類藥物一樣,阿米卡星也有潛在的耳毒性��、腎毒性以及神經肌肉毒性���。耳毒性主要是對第八腦神經的毒性作用,會導致聽覺喪失����、平衡失調或者兩者同時發(fā)生。在腎損害患者中�����,氨基糖苷類藥物出現神經毒性的風險性更大��。高頻耳聾通常最先出現����,并且僅能夠通過聽覺測試檢查出來��。神經毒性的其他表現還有麻木�、皮膚針刺感����、肌肉抽搐和驚厥等。氨基糖苷藥物的耳毒性通常是不可逆的����。腎毒性主要表現是腎功能不全,嚴重的可導致急性腎損傷��。神經肌肉毒性主要是急性肌肉麻痹和呼吸暫停�����。阿米卡星注射劑還有發(fā)生嚴重過敏反應的風險�,包括過敏性休克,嚴重者可導致死亡�。使用阿米卡星時請仔細閱讀藥品說明書,對于接受阿米卡星的患者需要進行密切臨床觀察���。
4.2 關注心血管系統(tǒng)用藥風險?
心血管系統(tǒng)用藥是指用于心臟疾病治療�、血管保護、血壓和血脂調節(jié)的藥品����,包括降血壓藥、抗心絞痛藥��、血管活性藥���、抗動脈粥樣硬化藥��、抗心律失常藥�、強心藥和其他心血管系統(tǒng)用藥�����。近年來�,心血管系統(tǒng)用藥不良反應/事件報告數量及嚴重報告占比均呈現上升趨勢�,提示應對該類藥品風險給予更多關注。
2020年全國藥品不良反應監(jiān)測網絡共收到心血管系統(tǒng)用藥的不良反應/事件報告15.7萬份�����,占總體報告的9.3%��;其中嚴重報告9,008份,占5.7%���。
4.2.1 涉及患者情況
按性別統(tǒng)計���,2020年心血管系統(tǒng)用藥不良反應/事件報告中,女性患者比男性患者高2.6個百分點��;嚴重報告中��,男性患者比女性患者高2.1個百分點����。
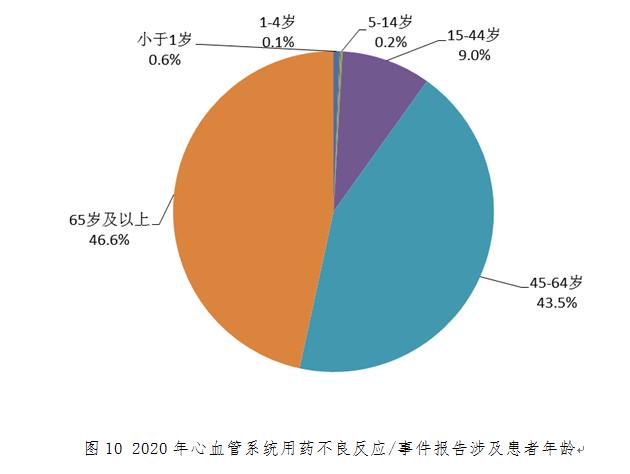
按年齡統(tǒng)計,2020年心血管系統(tǒng)用藥不良反應/事件報告中�����,45-64歲與65歲及以上年齡組分別占43.5%和46.6%(圖10)�����,遠高于其他年齡組比例��;嚴重報告中����,65歲及以上年齡組占52.4%�。
4.2.2 涉及藥品情況
2020年心血管系統(tǒng)用藥不良反應/事件報告數量排名前3位的藥品類別是降血壓藥�����、抗心絞痛藥��、抗動脈粥樣硬化藥�����;心血管系統(tǒng)用藥嚴重報告數量排名前3位的藥品類別是抗動脈粥樣硬化藥���、降血壓藥����、抗心絞痛藥�。
2020年心血管系統(tǒng)用藥不良反應/事件報告中,注射劑占29.0%�����,口服制劑占70.1%��,其他劑型占0.9%����;嚴重報告中,注射劑占44.1%����,口服制劑占55.4%,其他劑型占0.5%�。
4.2.3 累及器官系統(tǒng)情況
2020年心血管系統(tǒng)用藥不良反應/事件報告中,口服制劑累及器官系統(tǒng)排名前5位是肝膽系統(tǒng)疾病���、各類檢查�、各類神經系統(tǒng)疾病���、全身性疾病及給藥部位各種反應�、皮膚及皮下組織類疾?����?;注射劑累及器官系統(tǒng)前5位是全身性疾病及給藥部位各種反應、各類神經系統(tǒng)疾病�、皮膚及皮下組織類疾病��、心臟器官疾病�����、呼吸系統(tǒng)��、胸及縱隔疾?。▓D11)��。

4.2.4 監(jiān)測情況分析及安全風險提示
統(tǒng)計分析結果顯示����,心血管系統(tǒng)用藥不良反應/事件報告中,65歲及以上年齡組患者報告占比及嚴重報告占比均明顯高于總體報告中該年齡組患者水平�����,提示老年患者是心血管系統(tǒng)用藥的主要群體���,醫(yī)務人員和患者應關注發(fā)生嚴重不良反應的風險�����。
2020年心血管系統(tǒng)用藥不良反應/事件報告中�����,口服制劑的報告占比明顯高于注射劑�����,提示心血管系統(tǒng)用藥不良反應/事件報告更多來自口服給藥途徑����,同時不除外與疫情期間患者的診治方式發(fā)生變化有關�����?�?诜苿┲?�,硝苯地平不良反應/事件報告數量最多�。這可能與高血壓患者需要長期用藥,使用較多有關��;嚴重不良反應/事件報告中���,他汀類藥品報告數量最多��。這可能與他汀類藥品使用較多有關����,他汀類藥品除用于血脂代謝紊亂及相關心血管疾病的治療,還用于此類疾病的預防��;此外���,不排除其中存在的不合理����、不規(guī)范使用情況���,提示醫(yī)務人員和患者應關注此類藥品的風險����。
小貼士 :
患者使用降血壓藥類藥品應注意什么����?
降壓藥物為處方藥,使用需要醫(yī)生診斷和處方��。降血壓藥類藥品包括血管擴張類降壓藥、腎素-血管緊張素系統(tǒng)抑制藥����、利尿性降壓藥、交感神經抑制藥���、鈣通道阻滯藥等。此類藥品嚴重不良反應主要表現為頭痛��、肝功能異常����、胸部不適、頭暈�、呼吸困難、惡心�����、低血壓�����、寒戰(zhàn)等����。不同類別降壓藥物的不良反應存在差異��,患者在使用此類藥品前應仔細閱讀藥品說明書不良反應���、注意事項、警示���、禁忌等安全性提示信息���,服藥時應注意以下幾點:1.明確所服用高血壓藥的劑量及服用時間;2.從小劑量開始服用,不要隨意加大劑量或減少劑量���,嚴格按照醫(yī)囑服藥���;3.高血壓患者需要終生服用藥物;4.老年人降壓切忌過快���、過低����,應結合原來的血壓水平���,將其控制在合理范圍�;5.在服藥過程中如出現不適,應及時與醫(yī)生或藥師聯系����,避免發(fā)生嚴重不良反應。
4.3 關注診斷用藥風險
診斷用藥可分為醫(yī)學影像學檢查對比劑���、器官功能檢查用藥以及其他診斷用藥。臨床使用較為廣泛的診斷用藥有40多個品種��,以醫(yī)學影像檢查中使用的對比劑為主����,其種類較多,常用的有用于心血管造影的含碘對比劑�、用于磁共振的含釓對比劑以及消化道造影的硫酸鋇等。近年來��,含碘��、含釓對比劑的相關風險有所增加����,提示應對該類藥品風險給予關注����。
2020年全國藥品不良反應監(jiān)測網絡共收到診斷用藥的不良反應/事件報告1.7萬份�,占總體報告的1.0%;其中嚴重報告2,934份���,占17.2%���。
4.3.1 涉及患者情況
按性別統(tǒng)計,2020年診斷用藥不良反應/事件報告中����,男性患者比女性患者高7.9個百分點;嚴重報告中��,男性患者比女性患者高4.6個百分點�����。
按年齡統(tǒng)計�����,2020年診斷用藥不良反應/事件報告中�,14歲以下年齡組占1.1%���,15-44歲年齡組占18.7%,45-64歲與65歲及以上年齡組分別占50.2%和30.0%���,高于其他年齡組比例��;嚴重報告中�����,45-64歲與65歲及以上年齡組分別占48.0%和34.1%��。
4.3.2 涉及藥品情況
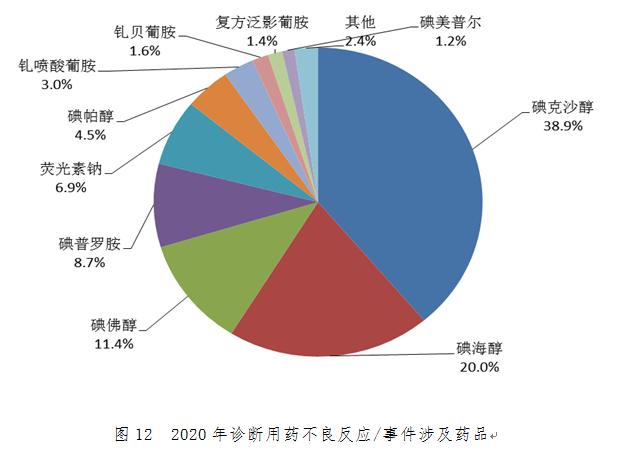
2020年診斷用藥不良反應/事件報告數量排名前3位的藥品是碘克沙醇、碘海醇��、碘佛醇(圖12)���;診斷用藥嚴重報告數量排名前3位的藥品是碘克沙醇��、碘海醇��、碘佛醇����。
4.3.3 累及器官系統(tǒng)情況
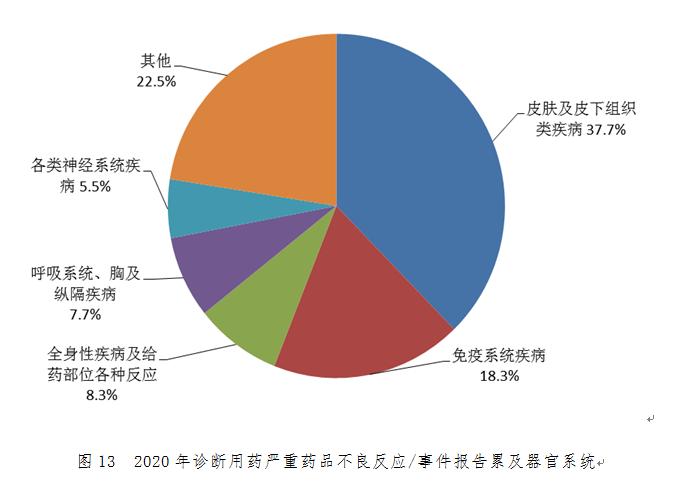
2020年診斷用藥嚴重不良反應/事件報告累及器官系統(tǒng)排名前5位的是皮膚及皮下組織類疾病、免疫系統(tǒng)疾病���、全身性疾病及給藥部位各種反應���、呼吸系統(tǒng)、胸及縱隔疾病�、各類神經系統(tǒng)疾病(圖13)��。診斷用藥嚴重不良反應/事件報告中���,不良反應主要表現為皮疹��、過敏性休克��、瘙癢癥����、類速發(fā)嚴重過敏反應�、呼吸困難、超敏反應���、胸部不適�����、血壓降低等�����。
4.3.4 監(jiān)測情況分析及安全風險提示
2020年診斷用藥不良反應/事件報告總數排名前10位品種主要為含碘對比劑和含釓對比劑��,嚴重不良反應/事件報告與以上情況相似����,其中含釓對比劑報告數量占比略有上升。2020年診斷用藥嚴重不良反應/事件報告相比于整體報告��,免疫系統(tǒng)疾病和呼吸系統(tǒng)�����、胸及縱隔疾病排名上升���,報告數占比增加。
診斷用藥不良反應/事件報告中��,45歲及以上年齡組患者報告占比在80%以上����,提示中老年患者是診斷用藥使用后產生不良反應的主要群體��,醫(yī)務人員和患者應關注該群體發(fā)生嚴重不良反應的風險���。
使用含碘或含釓對比劑的患者發(fā)生的過敏性休克等嚴重不良反應,時間過程通常比較短����,搶救不及時甚至有致命危險。對過敏性休克等嚴重反應要著重于嚴密觀察��、及早發(fā)現并及時處理�。造影檢查室內要配備各種處理和搶救的藥品和器械,要有掌握處理技能的醫(yī)護人員在場�����。同時�����,為進一步保障公眾用藥安全�����,生產企業(yè)應加強含碘、含釓對比劑的上市后安全性監(jiān)測與研究���,并及時將產品安全性信息傳達給醫(yī)務人員及患者��。
小貼士:
目前國內上市的含碘���、含釓對比劑有哪些?有哪些嚴重不良反應��?
對比劑種類多樣��,產品也不斷在更新換代����。目前國內上市的含碘對比劑主要包括碘海醇注射液、碘美普爾注射液����、碘佛醇注射液、碘帕醇注射液��、碘普羅胺注射液�����、碘克沙醇注射液����、碘比醇注射液、碘克沙酸葡胺鈉注射液�����、泛影葡胺注射液和復方泛影葡胺注射液��。國內上市的含釓對比劑主要包括有釓噴酸葡胺注射液����、釓雙胺注射液、釓貝葡胺注射液����、釓塞酸二鈉注射液、釓特酸葡胺注射液�����、釓特醇注射液��、釓布醇注射液。此類藥品嚴重不良反應主要表現為皮疹��、過敏性休克���、瘙癢癥�����、類速發(fā)嚴重過敏反應��、呼吸困難��、超敏反應等�。
使用含碘�����、含釓對比劑應注意什么����?
醫(yī)務人員及患者應仔細閱讀藥品說明書不良反應、注意事項����、警示���、禁忌等安全性提示信息��;患者在檢查過程中��,對個人健康狀況有疑問時�����,應及時詢問醫(yī)務人員���。使用含碘���、含釓對比劑過程中,要嚴密觀察��、及早發(fā)現并及時處理出現的嚴重不良反應�。造影檢查室內要配備各種處理和搶救的藥品和器械,要有掌握處理技能的醫(yī)護人員在場�����。公眾還可從國家藥品監(jiān)督管理局(www.nmpa.gov.cn)及國家藥品不良反應監(jiān)測中心(www.cdr-adr.org.cn)官方網站���,查詢到國家近年來發(fā)布的針對含碘�����、含釓對比劑相關風險的提示信息���。
4.4 關注注射劑用藥風險
2020年注射劑(不含疫苗)不良反應/事件與2019年同期相比����,總體報告數小幅下降��,嚴重報告數小幅增長�����。按照劑型統(tǒng)計���,2020年藥品總體不良反應/事件報告中注射劑(不含疫苗)占57.0%����,嚴重報告中注射劑(不含疫苗)占73.0%�����。按藥品分類統(tǒng)計,注射劑(不含疫苗)總體報告中化學藥品注射劑占88.1%���,中藥注射劑占7.8%�,生物制品占1.5%�����,無法分類者占2.6%��;注射劑(不含疫苗)嚴重報告中化學藥品注射劑占90.4%��,中藥注射劑占6.1%�,生物制品占1.4%�����,無法分類者占2.1%����。
4.4.1 藥品情況
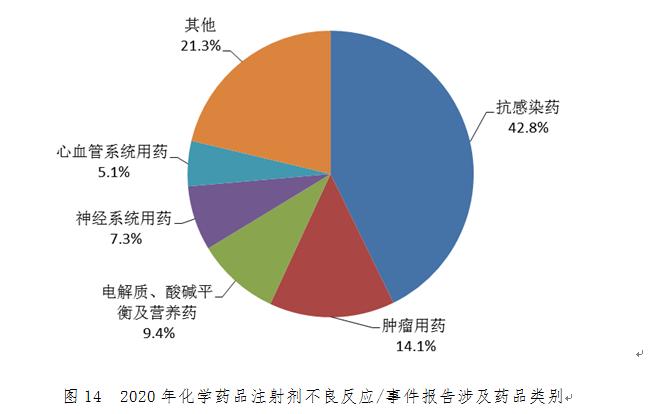
化學藥品注射劑報告數量排名前3位的藥品類別是抗感染藥,腫瘤用藥����,電解質��、酸堿平衡及營養(yǎng)藥(圖14)���。
????????????????????????????????? 
中藥注射劑總體報告涉及中藥注射劑類別排名前5位的是理血劑、補益劑��、開竅劑���、清熱劑����、祛痰劑(圖15)�。
4.4.2 累及器官系統(tǒng)情況
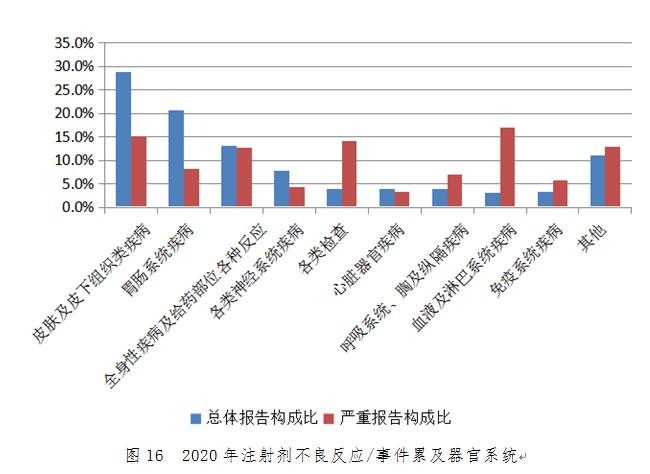
2020年注射劑總體不良反應/事件報告中,累及器官系統(tǒng)排名前5位的是皮膚及皮下組織類疾病�����、胃腸系統(tǒng)疾病�����、全身性疾病及給藥部位各種反應�����、各類神經系統(tǒng)疾病和各類檢查。注射劑嚴重不良反應/事件中��,累及器官系統(tǒng)排名前5位的是血液及淋巴系統(tǒng)疾病��、皮膚及皮下組織類疾病���、各類檢查���、全身性疾病及給藥部位各種反應和胃腸系統(tǒng)疾?。▓D16)。
4.4.3 監(jiān)測情況分析及安全風險提示
從劑型統(tǒng)計情況看��,2020年注射劑(不含疫苗)不良反應/事件總體報告數量與2019年同期相比小幅下降����,但占比仍然相對較高,與近年來總體情況基本一致��。從用藥人群統(tǒng)計情況看����,兒童的注射劑(不含疫苗)不良反應/事件報告數量與2019年同期相比小幅下降,但總體占比仍相對較高���。根據注射劑監(jiān)測情況��,建議臨床醫(yī)生用藥前仔細閱讀產品說明書����,重點關注相關安全性內容,處方前進行充分的獲益與風險分析���,始終遵照“能吃藥不打針�����,能打針不輸液”的用藥原則合理選擇用藥�����。兒童作為特殊用藥人群����,受臟器發(fā)育尚未完全等因素影響���,對藥物更為敏感��,耐受性較差�����,更應謹慎用藥����。
小貼士:
怎樣合理選擇給藥途徑?
臨床上給藥途徑多種多樣�,主要包括經胃腸道給藥途徑和非經胃腸道給藥途徑。經胃腸道給藥途徑���,即口服給藥途徑�,常見劑型如片劑����、顆粒劑��、膠囊劑�����、散劑����、溶液劑�、丸劑等�����;非經胃腸道給藥途徑�����,即除口服給藥途徑以外的所有其他途徑�,如注射給藥、呼吸道給藥�、皮膚給藥等,常見劑型如注射劑�、噴霧劑、外用溶液劑����、滴眼劑、栓劑等�。其中,注射給藥途徑包括皮下注射����、皮內注射���、肌內注射、靜脈注射等�。不同給藥途徑具有不同的臨床意義,如口服給藥途徑����,是最常用,相對安全�����、方便��、經濟的給藥途徑�����;注射給藥途徑���,優(yōu)點是吸收快,藥量準確可控���,缺點是未經過人體的天然屏障�,直接進入體內,可引起組織損傷���、疼痛�����、感染��,甚至嚴重不良反應����。臨床上應根據用藥實際��,遵循“能口服給藥的�,不選用注射給藥;能肌內注射給藥的�����,不選用靜脈注射或滴注給藥”的原則���,合理選擇給藥途徑����。
4.5 關注老年人用藥安全
2020年全國藥品不良反應監(jiān)測網絡中65歲及以上老年患者相關報告占30.3%,較2019年略有升高�。2020年共收到老年患者嚴重報告占老年患者報告總數的11.5%,高于2020年總體報告中嚴重報告比例�����。
4.5.1 涉及老年患者情況
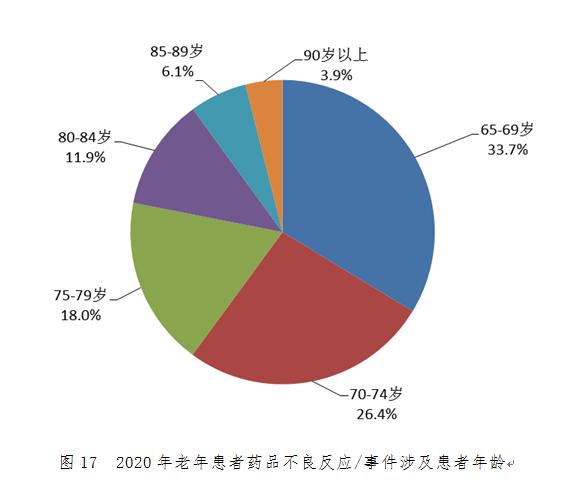
2020年老年患者藥品不良反應/事件報告中���,男性和女性患者比例為0.97:1�。65-69歲老年患者報告占33.7%��,70-74歲老年患者報告占26.4%(圖17)��。
4.5.2 涉及藥品情況
按照藥品類別統(tǒng)計��,化學藥品占84.6%����,中藥占12.3%,生物制品占0.6%��,無法分類者占2.5%����。化學藥品排名前5位的是抗感染藥��、心血管系統(tǒng)用藥�、腫瘤用藥、神經系統(tǒng)用藥�、電解質、酸堿平衡及營養(yǎng)藥;中藥排名前5位的是理血劑�、補益劑、祛濕劑��、清熱劑�、開竅劑。
按照藥品給藥途徑統(tǒng)計����,注射給藥占61.7%、口服給藥占34.4%�、其他給藥途徑占3.9%(圖18)。注射給藥中�����,靜脈注射給藥占92.7%���、其他注射給藥占7.3%��。
4.5.3 累及器官系統(tǒng)情況
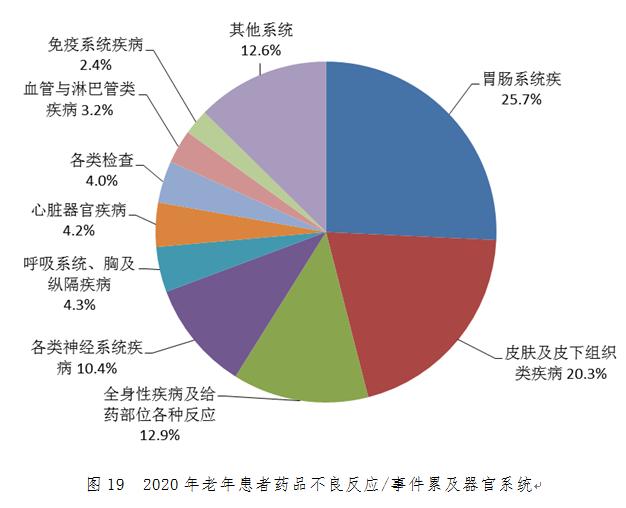
2020年老年患者藥品不良反應/事件報告中�����,累及器官系統(tǒng)排名前5位的是胃腸系統(tǒng)疾病���、皮膚及皮下組織類疾病�����、全身性疾病及給藥部位各種反應��、各類神經系統(tǒng)疾病����、呼吸系統(tǒng)�、胸及縱隔疾病,化學藥品�、中藥累及器官系統(tǒng)排名前5位的與總體基本一致(圖19)。
4.5.4 監(jiān)測情況分析及安全風險提示
2020年老年患者藥品不良反應/事件報告占報告總數的30.3%�,老年患者嚴重藥品不良反應/事件報告所占比例高于總體報告中嚴重報告的構成比,提示老年患者受基礎疾病較多��、機體代謝水平較差以及用藥情況復雜等因素影響,發(fā)生藥品不良反應的風險更大���,因此仍應持續(xù)關注老年人群用藥安全。
從2020年統(tǒng)計數據看����,在藥品類別分布上,老年患者用藥的化學藥品中�����,與2019年相同����,心血管系統(tǒng)用藥、神經系統(tǒng)用藥的構成比高于該類別藥品在化學藥品總體報告中的構成比�,提示老年患者使用以上藥品較多,不良反應發(fā)生情況較多�;中藥排名居前的藥品類別為理血劑、補益劑��、祛濕劑����,這3類藥品的使用與老年人疾病譜和生理特點有關。
小貼士:
老年患者及家屬應如何提高安全用藥的認識��?
我國老年人口眾多,而老年人常常同時患有多種慢性疾病���,隨著年齡的增加���,老年人罹患多種疾病和接受多種藥物治療的機會明顯增加,多重用藥可明顯增加因藥物之間相互作用所導致的藥物不良反應的風險��。因此應提高老年患者及家屬安全用藥的認識和能力���,最大限度地減少藥物治療中給患者帶來潛在的藥源性損害�,保障老年患者的用藥安全�����。
鼓勵老年患者按時門診隨訪�,知曉自己健康狀況,一旦出現藥物治療相關的異常反應����,及時就診。建議老年患者設立個人專用藥物記錄本記錄用藥及不良反應���。同時���,家屬需定時檢查老年患者用藥情況�,做到按時���、按醫(yī)囑規(guī)定劑量服藥��,要協(xié)助患者提高用藥依從性和對藥物的管理。老年人由于記憶力減退��,容易漏服�、多服、誤服藥物�,以致難以獲得療效或加重病情。
此外�����,建議老年人及其家屬避免隨意自我藥療��,不宜憑自己的經驗自作主張��,隨便聯合用藥����。切記不要輕信民間“偏方”�、“秘方”�����,以免造成延誤治療或因藥物間相互作用帶來療效下降或毒性增加�����。
第5章 有關說明
5.1 本年度報告中的數據來源于國家藥品不良反應監(jiān)測數據庫中2020年1月1日至2020年12月31日各地區(qū)上報的數據����。
5.2 與大多數國家一樣,我國藥品不良反應報告是通過自發(fā)報告系統(tǒng)收集并錄入到數據庫中的��,存在自發(fā)報告系統(tǒng)的局限性�,如漏報、填寫不規(guī)范�、信息不完善、無法計算不良反應發(fā)生率等��。
5.3 每種藥品不良反應/事件報告的數量受到該藥品的使用量和不良反應發(fā)生率等諸多因素的影響���,故藥品不良反應/事件報告數量的多少不直接代表藥品不良反應發(fā)生率的高低或者嚴重程度��?���!?/span>
5.4 本年度報告完成時,其中一些嚴重報告�����、死亡報告尚在調查和評價的過程中����,所有統(tǒng)計結果均為現階段數據收集情況的真實反映����,并不代表最終的評價結果。
5.5 本年度報告統(tǒng)計時采用監(jiān)管活動醫(yī)學詞典(MedDRA)�,既往采用世界衛(wèi)生組織不良反應術語集(WHO-ART)。MedDRA是在人用藥品技術要求國際協(xié)調理事會(ICH)主辦下編制的標準化國際醫(yī)學術語集����,用于與人用醫(yī)療產品相關的監(jiān)管溝通和數據評估。
5.6 專業(yè)人士會分析藥品與不良反應/事件的關聯性�,提取藥品安全性風險信息,根據風險的普遍性或者嚴重程度��,決定是否需要采取相關措施,如在藥品說明書中加入安全性信息��,更新藥品如何安全使用的信息等��。當藥品的獲益不再大于風險時�,藥品也會撤市。
5.7 本年度報告數據均來源于全國藥品不良反應監(jiān)測網絡�����,不包含疫苗不良反應/事件的監(jiān)測數據�。